- 작성자관리자
- 작성일시2022.06.16 14:52
- 조회수2,807
바이오 의약품 PK 평가
및 일반독성 시험 서비스
1. PK 평가
1.1. 개요
약물동태학 (Pharmacokinetics;
PKs)은 체내에 투여된 약물에 대하여 시간 경과에 따른 흡수(Absorption), 분포
(Distribution), 대사 (Metabolism) 및
배설 (Excretion) 과정을 수학적인 계산을 통해 정량적으로 이해하고자 하는 연구 분야로, 약효를 기대하는 용량에서 약물의 노출부터 배설까지의 동태를 평가합니다. PK
평가는 혈액, 조직, 요, 분변 등의 생체시료에서 약물의 농도를 측정하여 PK Parameter를
산출하고, 이를 바탕으로 임상투여용량의 설정에 필요한 정보를 제공하는데 그 의의가 있습니다. 신약개발지원센터에서는 식품의약품안전처 고시 「의약품의 품목허가·신고·심사 규정」 및 「생물학적 제제 등의 품목허가·심사 규정」에 따라
「생체시료 분석법 밸리데이션 가이드라인」에 적합한 시험결과를 도출하는 PK 평가 서비스를 제공하고 있습니다. 특히 바이오의약품에 최적화된 항원-항체 반응을 이용한 비임상 PK 평가 지원을 통해 신약개발 상업화 촉진에 기여하고 있습니다.
1.2.
시험과정

1.3. 시험방법
□ Enzyme linked immunosorbent assay (ELISA)는 항원-항체 간의 상호작용을 이용하여 시료 내 약물의 농도를 정량적으로 분석합니다. ELISA는 특정 항원 또는 항체에 대한 민감도와 특이도가 높고, 다량의 시료를 동시에 처리할 수 있습니다.
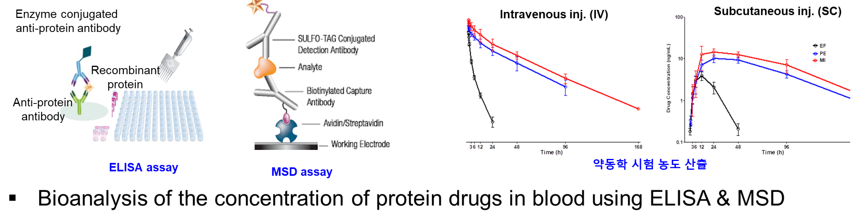
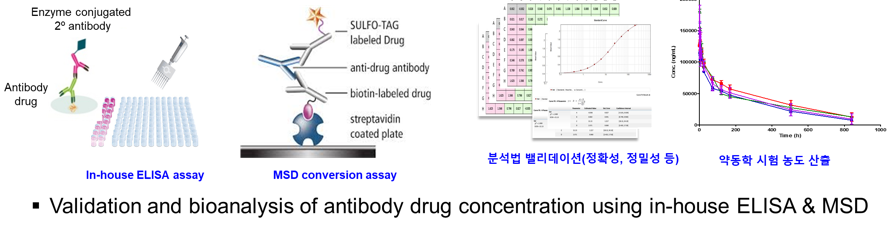
□ LC-MS/MS (Liquid chromatography-tandem mass spectrometry)는 시료를 질량 대 전하 비(m/z)에 따라 이온을 분리함으로써 분석하고자 하는 물질만을 고유하게 분석합니다.
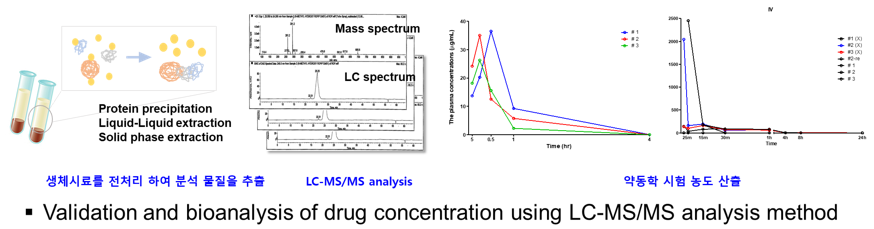
1.4.
평가항목

□ Feasibility test: 분석 가능
유무를 판단하는 과정
□ Method development: 최적의 분석법을
개발하는 과정
□ Method validation: 개발한 분석법의
재현성 및 정확성에 대한 타당성을 입증하는 과정
□ Sample analysis: 시험 시료를
분석하는 과정
□
Incurred sample reanalysis: 시험 시료 분석 결과에 대한 신뢰성을 확보하는 과정

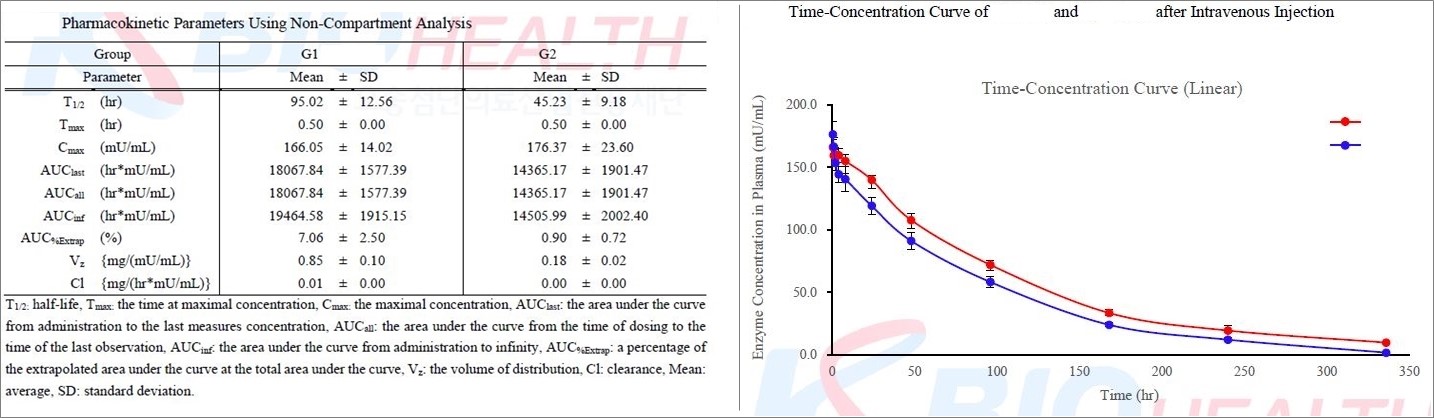
시료분석
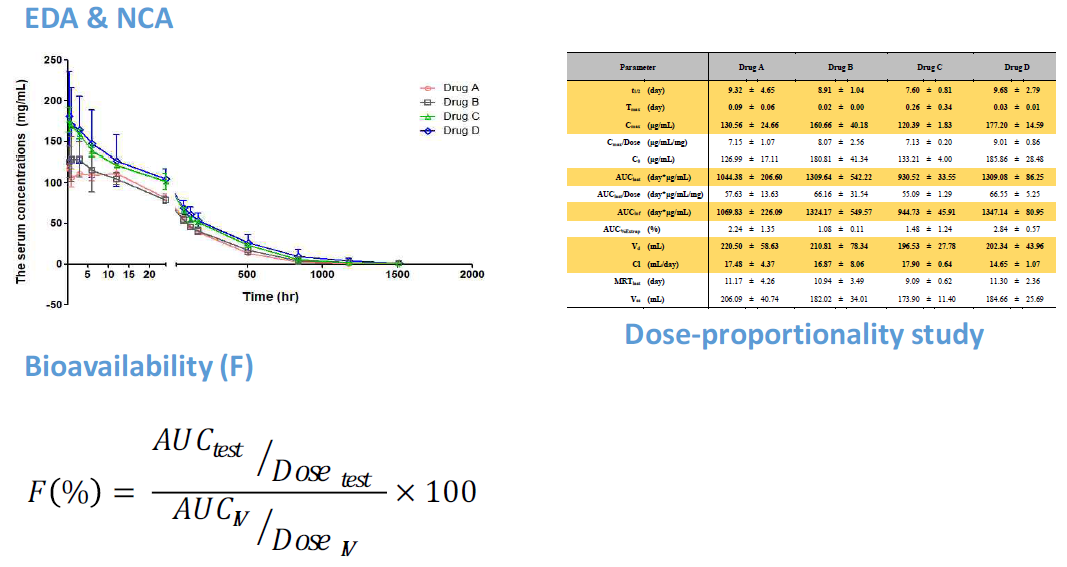
결과를 토대로 Phoenix WinNonlin 소프트웨어를 이용한 Non-compartmental
analysis (NCA)를 수행하여 PK parameter를 산출합니다.
□
약동학 평가변수: Cmax, Tmax, t1/2, AUC, Clearance,
Volume of distribution, 소실속도상수 등
1.5.
지원사례 및 실적
신약개발지원센터에서는
생체시료 내 recombinant protein, antibody, antibody-drug conjugate,
peptide 등에 대하여 ELISA 또는
LC-MS/MS를 이용한 정량분석을 통해 다음과 같이 다양한 약동학 평가 서비스를 제공하고 있습니다.
□ P사 통풍치료제 후보물질의 약동학 평가
□ K대 후보물질 G에 대한
약동학 평가
□ D대 차세대 ADC 항암파이프라인
후보물질에 대한 약동학 평가
□ K대 융합단백질에 대한 약동학 평가
□ R사 재조합단백질에 대한 약동학 평가
□ H대 펩타이드 약동학 평가
상기
외, 다수 수행
1.6.
참고문헌
□ 생체시료분석법 밸리데이션 가이드라인, 식품의약품안전처 2013
□ 비임상시험 관리기준, 제2018-93호, 식품의약품안전처
□ 임상약물동태학의 개념과
응용, 권광일, 신일북스,
2011
□ Pharmacokinetics 2nd edition, Milo Gibaldi, Donald Perrier,
Informa, 2007
□ WinNonlin user’s guideline, Pharsight
1.7.
문의처 : 안전성PK팀 팀장 류지호 (043-200-9331, jhryu@kbiohealth.kr)
2.
2.1. 개요
비임상 일반독성시험은 임상시험에 필요한 약물의 안전한 투여용량 및
용법을 확인하고 입증하는 과정으로, 임상시험에서 예상되는 충분한 독성정보를 확인하는데 그 의의가 있습니다. 식품의약품안전처 고시 「의약품의 품목허가·신고·심사 규정」 및 「생물학적 제제 등의 품목허가·심사 규정」에 따르면
생물학적제제, 유전자재조합의약품, 세포배양의약품, 세포치료제, 유전자치료제 및 이하 유사한 제제는 「의약품 등의 안전에
관한 규칙」 제4조에 따라 안전성·유효성 심사가 요구됩니다. 임상시험계획승인 신청 시 안전성·유효성 심사에 필요한 독성에 관한
자료는 식품의약품안전처 고시 「비임상시험 관리기준」에 적합한 자료로서, 「의약품등의 독성시험기준」에
적합한 자료 또는 시험방법 및 평가기준 등이 과학적·합리적으로 타당성이 인정되는 자료여야 하며, 통상적으로 단회투여 독성시험 및 반복투여 독성시험을 수행하여 그 결과를 제출하도록 하고 있습니다. 신약개발지원센터는 「비임상시험 관리기준」에 준하여 시험을 수행하고 있는 Non-GLP
기관으로, 임상시험계획승인 신청 시 안전성·유효성
심사 자료로 Non-GLP 기관에서 수행이 가능한 단회 독성시험과 투여용량 결정을 위한 Dose range finding 시험에 대한 결과를 제공하고 있습니다. Non-GLP
독성시험은 개발과정 초기에 Go/No-Go를 결정하는 자료로도 유용하게 활용될 수 있습니다.
일반독성시험은 임상에서의 안전한 초회 투여용량 결정 및
증량 계획 수립을 위하여 수행하는 것으로, 비임상 단계에서 시험물질의 무독성량과 독성의 잠재적 표적
기관을 확인합니다. 또한 필요 시 독성동태시험을 통하여 독성용량에서의 혈중 시험물질의 노출도를 확인하거나
회복시험을 통하여 시험물질 투여에 의한 것으로 판단되는 증상 및 독성에 대한 회복성을
평가합니다.
2.2.
시험 과정

2.3.
고려사항
비임상 일반독성시험에서의
투여 빈도는 임상 투여 빈도를 반영하여 결정하게 됩니다. 단회투여 독성시험은 반복투여 독성시험의 용량
설정을 위하여 수행하거나 유의미한 독성이 예상되는 경우에만 실시하는 등, 시험물질에 따라 시험 디자인은
차이가 있습니다. 합성의약품의 경우 단회투여 및 반복투여 독성시험에 대한 가이드가 명확하지만, 바이오의약품은 임상에서 단회투여 할 경우, 비임상 시험의 투여 횟수는
단회로 하되 시험 절차 및 평가항목은 반복투여 독성시험에 준하여 수행하여야 합니다.
바이오의약품에 의한 독성은 ‘과다한 약리작용에 의한 부작용’으로 해석하고 있습니다. 따라서, 독성시험을 위한 동물종은 약물의 표적이 되는 수용체 또는 에피토프의 발현을 통해 시험물질이 약리학적 활성을 나타내는 것을 선택하여야 합니다. 적절한 동물종이 존재하지 않는 경우, 약리기전을 고려하여 약물의 표적이 되는 사람 수용체를 발현하는 적절한 형질전환 동물의 활용이나 동종 단백질의 사용을 고려해야 합니다.
비임상 독성시험에서의 투여경로는 원칙적으로 임상 예정경로를 사용하며, 비임상 효능 및 PK 평가와 동일한 경로를 사용합니다. 투여 용량의 적절한 안전성 한계를 결정하는데 필요한 사람 대상 용량의 배수는 시험물질의 종류와 적응증에 따라
달라질 수 있습니다. 예컨대, 항체 의약품의 비임상 독성시험
고용량군의 용량은 선정된 동물 종에서 최대 약리작용을 나타내는 용량 또는 임상 최대 노출량의 약 10배의
노출용량 중 더 높은 용량으로 선정하는데, 사람 세포보다 선택한 종의 동물 세포에서 약물의 친화성 또는
역가가 낮을 경우 보다 높은 용량으로 시험해야 합니다.
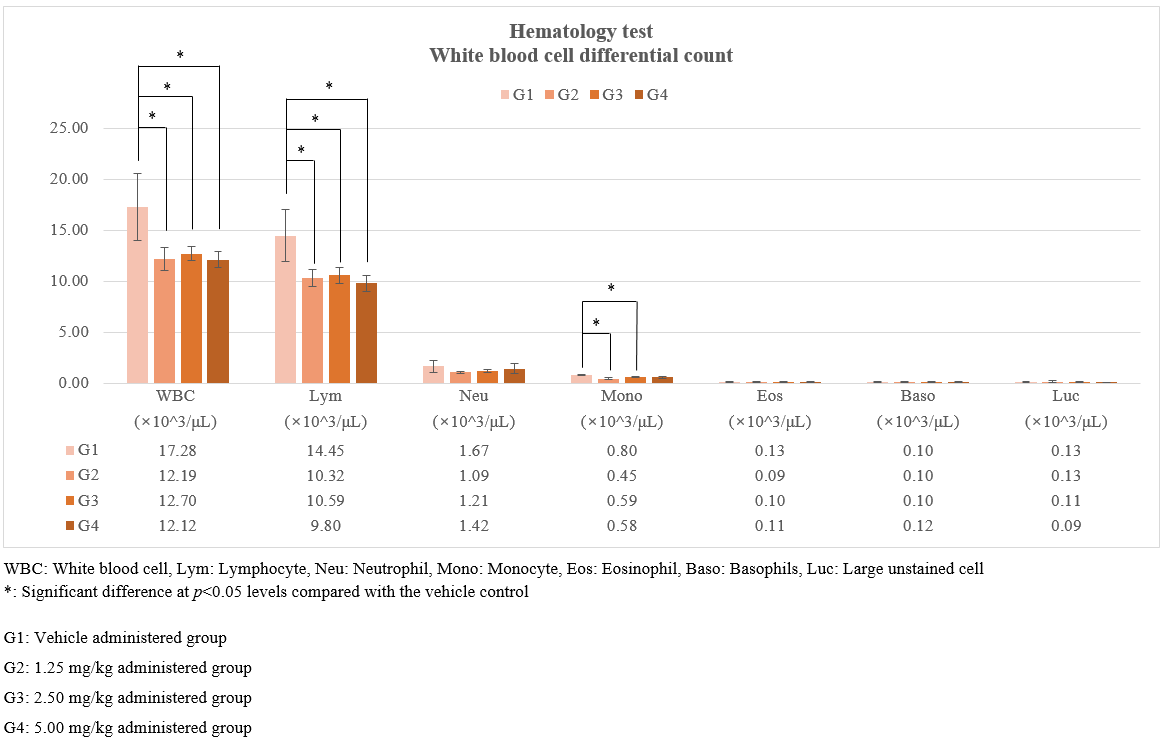
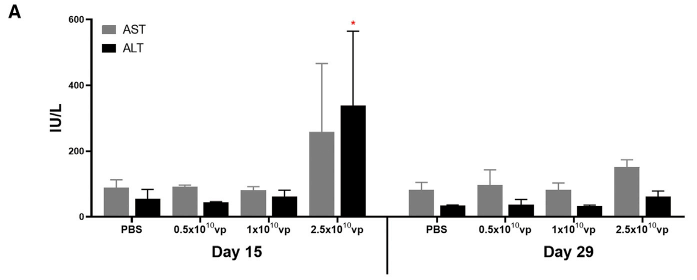
2.4. 평가항목
시험물질에 대한 독성학적 위해성 여부는 일반증상 관찰, 체중 측정, 부검소견, 혈액학적
검사, 혈액생화학적 검사, 요검사, 장기중량 측정, 조직병리학적 검사 등, 여러 평가항목에 대한 통계분석 결과를 종합적으로 고려하여 평가하게 됩니다.
2.5. 지원사례 및 실적
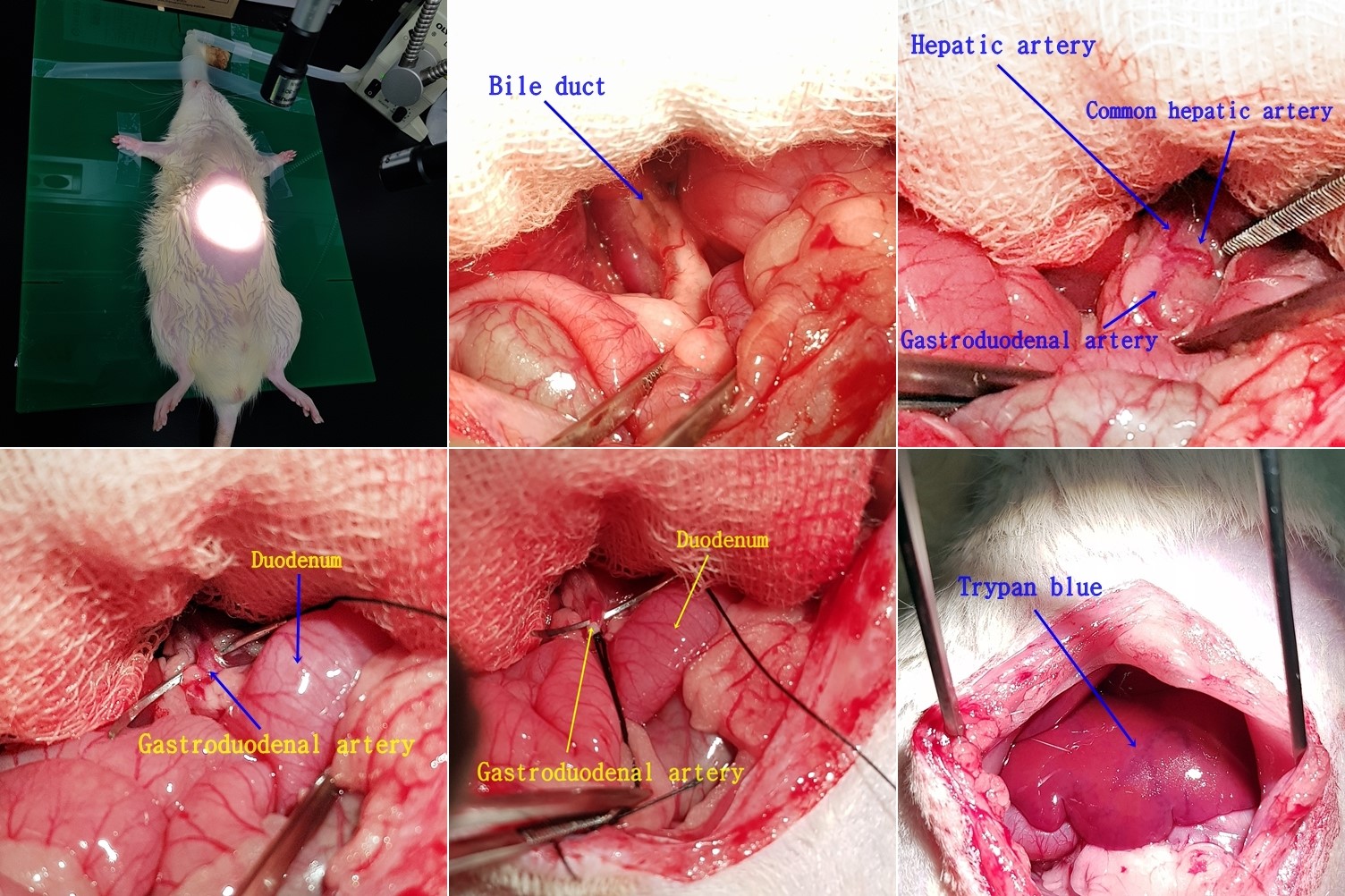
신약개발지원센터는 Intrathecal
injection, Hepatic artery injection 등 특수 투여 경로에 대한 투여법을 확립하고, 연간 약 20건 이상의 일반독성시험에 대한 전문적인 서비스를 지원하고
있습니다. 또한 재단에서 수행된 시험 결과가 논문에 등재되는 등 신약개발 지원을 통해 상업화와 가치
증진에 기여하고 있습니다.
□ T사 시험물질 2종에 대한
일반독성시험
□ A대 c-Kit target
antibody에 대한 일반독성시험
□ A대 c-Kit
target antibody drug conjugate에 대한 일반독성시험
□ K대 융합단백질 2종에 대한 일반독성시험
□ One Stop 패혈증 치료제 후보물질에
대한 일반독성시험
□ H사 후보물질 VMOOO에 대한 일반독성시험
□ R사 Ad-ECRT 유전자
치료제에 대한 일반독성시험
상기
외, 다수 수행

2.6. 참고문헌
□ 의약품의 품목허가·신고·심사 규정, 제2021-90호, 식품의약품안전처
□ 생물학적제제 등의 품목허가·심사
규정, 제2021-29호,
식품의약품안전처
□ 비임상시험 관리기준, 제2018-93호, 식품의약품안전처
□ 의약품등의 독성시험기준, 제2022-18호, 식품의약품안전처
2.7. 문의처 : 안전성PK팀 팀장 류지호 (043-200-9331, jhryu@kbiohealth.kr)

